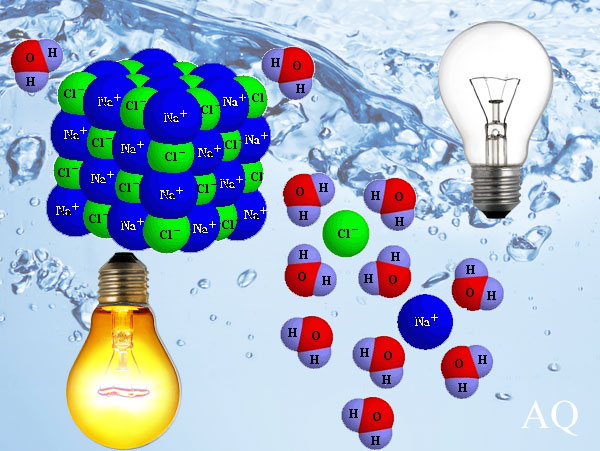
О том, почему вода проводит ток, ученые спорят уже более двух столетий.
 Так как молекулы воды не имеют заряда, то и электричество они не проводят. Поэтому дистиллированная вода считается диэлектриком, то есть ток она не проводит. Но если в воду добавить даже очень небольшое число ионов, ее электропроводность резко вырастает и она становится полноценным проводником. Всем известно, что вода и электричество — весьма опасное сочетание.
Так как молекулы воды не имеют заряда, то и электричество они не проводят. Поэтому дистиллированная вода считается диэлектриком, то есть ток она не проводит. Но если в воду добавить даже очень небольшое число ионов, ее электропроводность резко вырастает и она становится полноценным проводником. Всем известно, что вода и электричество — весьма опасное сочетание.
Чтобы в этом разобраться, нужно представить атом, который состоит из протонов, нейтронов и электронов. Соотношение нейтронов и электронов определяют заряд атома. Если число протонов больше, чем электронов, заряд положительный, если наоборот — отрицательный. Поскольку атомы стремятся к нейтральному заряду, они отдают или забирают электроны. При переходе электрона от отрицательно заряженного атома к атому с положительным зарядом образуется электрический ток.
Молекулы дистиллированной воды заряда не имеют. Однако такая вода встречается нечасто.
Вся вода, которая течёт из-под крана, содержится в реках, озёрах и морях, — это минеральный раствор той или иной концентрации. В ней содержатся как положительно (кальций, магний, натрий, железо), так и отрицательно (хлор, сульфат, карбонат) заряженные частицы, поэтому такая вода хорошо проводит ток, и тем лучше, чем больше концентрация минеральных солей.
Когда через воду проходит ток, атомам кислорода при этом почти не приходится двигаться. Этот процесс можно сравнить с знаменитой «колыбелью» Ньютона, набором подвешенных шариков, выстроенных в линию. Если поднять один из них и ударить им по линии, только концевые шарики будут двигаться, а остальные будут стоять на месте.
В начале 19 века немецкий химик Теодор Гротгус предложил теорию, которая объясняла то, почему вода пропускает через себя ток и почему электричество может разлагать ее на водород и кислород. Он посчитал, что молекулы воды могут захватывать лишние протоны и передавать их друг другу, подобно палочке в эстафете, благодаря формированию новых водородных и ковалентных связей и их быстрому распаду. Как выглядят молекулы воды, участвующие в обмене протонами, до настоящего времени никто не знал, так как проследить за этим процессом крайне сложно из-за его скоротечности и крайне малых масштабов, на которых протекает эта реакция.
Йельским химикам удалось решить эту задачу, обнаружив, что подобные реакции замедляются и становятся видными для инструментов при исполнении двух условий – охлаждения небольшого количества молекул воды почти до абсолютного нуля и использования только «тяжелой» воды – молекул, состоящих из обычного кислорода и дейтерия, тяжелого изотопа водорода.
Подсвечивая такие молекулы при помощи лучей инфракрасного лазера и наблюдая за изменениями в их спектре, ученые смогли увидеть, как свободные ионы дейтерия присоединяются к тяжелой воде, и как они «перепрыгивают» на соседнюю с ней молекулу.
Как показали эти наблюдения, подобные обмены идут не между отдельными молекулами воды, а между своеобразными «коллективами» их молекул, объединяющие в себе четыре молекулы H2O, сообщает phys.org. Это, в целом, подтверждает то, что раньше подозревали ученые на базе компьютерных расчетов, но не могли доказать этого на практике.
Пожалуйста, ответьте на наши опросы. Несколько минут, потраченных вами на голосование, позволят нам понять, как сделать наш сайт и портал более интересным и нужным!